Коррозия "для блондинок"
Чтобы понять, попробуй объяснить это простыми словамиПортреты протекторов этого года, отработавших в общей сложности 10 месяцев (два сезона), правый борт - корма, нос, левый борт - корма, нос. Разницу видно невооруженным взглядом.
Почему аноды разрушились по-разному?
Каждый раз, поднимаясь из воды, катерщики и парусники озабоченно изучают свои полуразрушенные (или нетронутые) цинковые аноды, делая какие-то только им известные выводы. Некоторые соединяют электрическими проводами все металлические детали своих "пароходов", другие, наоборот, изолируют все, что можно, а третьи вообще не обращают на это внимания, просто меняют изношенные аноды и испорченные узлы. Теория гальванической коррозии не является тайной, практическоие рекомендации общеизвестны, но "дьявол кроется в деталях", которые иногда приводят к неожиданным результатам.
Далее - практическое расследование некоторых особенностей коррозии металлов в морской воде, естественно, с шаманством и заклинанием духов.
Содержание статьи
- Теория - электрохимический ряд напряжений металлов
- Разные металлы в воде, калибровка опытной установки
- Электрический потенциал и ток
- Два опыта с гальваническими ячейками
- Практический пример №1 - несимметричное разрушение анодов протекторной защиты
- Практический пример №2 - коррозия валопровода и сальника гребного вала на "Чаве" в 13-14 годах
- Общий "ноль" и изоляция
Начнем с самого начала, с электрохимического ряда напряжений металлов.
Еще в школе нас знакомили с такой особенностью окружающего мира, что каждый металл имеет собственный электрический потенциал, что нет металлов с одинаковым потенциалом, и что при погружении в электролит электродов из разных металлов между ними возникает разность электрических потенциалов, которую можно измерить чувствительным вольтметром. На этом теоретическую часть мы закончим, и перейдем к практике.
Классический школьный ряд напряжений с точки зрения моряка, нам не очень подходит, однако есть практические таблицы - "Galvanic Series in Metals in Seawater". Во-первых, в них использованы результаты измерения потенциалов металлов и сплавов, используемых при строительстве судов, во-вторых, в качестве электролита применялась проточная морская вода - при температурах от +10 до +27 градусов Цельсия, и скоростях потока 5 - 8 узлов.
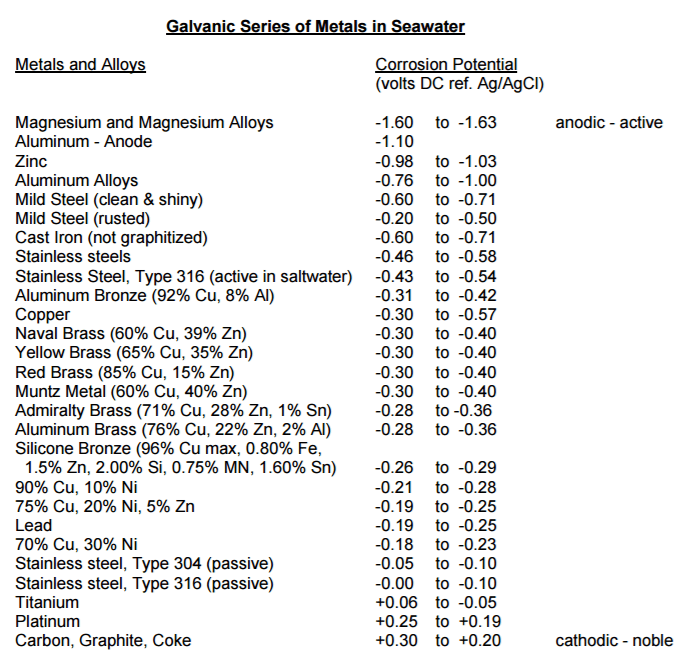
Что все это значит с точки зрения нашей морской практики и как это можно применить?
Первое, что бросается в глаза при анализе этой таблицы - довольно заметная разность электрических потенциалов у "обычной" углеродистой стали и "нержавейки". Цифры - цифрами, но для ясного понимания, ну, и, конечно, "из любви к искусству" напрашивается эксперимент, для которого понадобятся образцы деталей нашей лодки, вольтметр с приличным входным сопротивлением, и банка свежей морской воды.



