Электрический потенциал и электрический ток
Измеренные нами электрические потенциалы каждого из образцов - их врожденные способности, возможности сделать работу. В руководствах "для блондинок" обычно приводят аналогии потенциальных возможностей в виде подвешенных грузиков, или машины, стоящей на тормозах на уклоне. Возможность есть, но чтобы она превратилась в рабочий процесс, нужно обрезать веревочку, на которой висит грузик, или снять машину с ручника.
В данном случае, для самореализации, наша пара металлов должна, во-первых, находиться в воде или во влажной атмосфере. Это условие для возникновения разности потенциалов. Это - состояние.
Во-вторых, наша пара должна получить электрический контакт между собой. При этом условии возникнет электрический ток, который и начнет что-то делать. Состояние превратится в действие.
Металл, у которого потенциал в паре отрицательный, называется анодом, металл (или графит, который в электротехнике приравняли к металлам), потенциал которого в паре положительный, называется катодом.
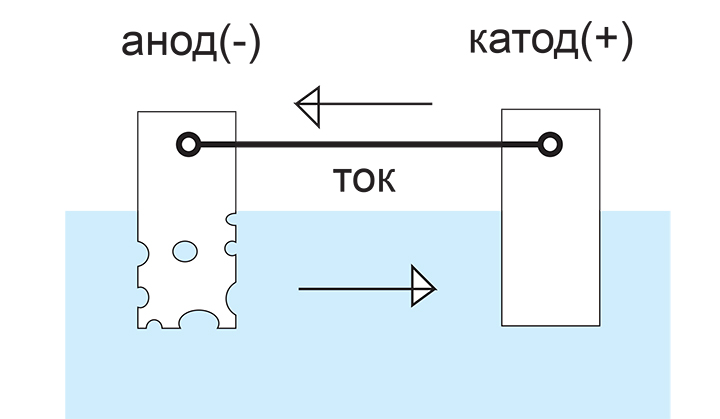
Металлы и сплавы металлов подвержены гальванической коррозии из-за неоднородности своих свойств, гальванические пары с небольшой разностью потенциалов возникают прямо на поверхности контакта с водой. Кроме того, в металлах присутствуют "блуждающие" токи, вызванные множеством причин. Протекающий по металлу ток в присутствии воды - еще одна причина гальванической коррозии.
Работа электрического тока в процессе гальванической коррозии направлена на разрушение анода. При этом катод почти не затрагивается процессом.
На этом основан принцип защиты металлов от коррозии с использованием "жертвенных" анодов, когда к металлу корпуса, например, из стали (с потенциалом -0,6 Вольта) прикрепляют анод из цинка (с потенциалом -1 Вольт). В результате разности потенциалов в 0,4 Вольта хватает для того, чтобы образовать "вечную" батарейку, работающую на разрушение цинкового анода.
Этот "подпор" электричества убирает фон "местных" гальванических пар и "блуждающие" токи, обеспечивая защиту основного металла.